Calor y Temperatura
UNIDAD CALOR
Para comenzar esta unidad debemos tener claras las diferencias entre calor (Q) y temperatura (T), debido a que estos conceptos generalmente nos llevan a errores. El primero de ellos se refiere a un intercambio de energía, muy parecido al concepto de trabajo mecánico; y el segundo tiene su explicación en la sensación de caliente o frío que tenemos al tocar una sustancia; esta propiedad nos permite determinar si un cuerpo esta en equilibrio térmico (igualdad de temperatura).
La clasificación de una sustancia como fría, tibia o caliente, es algo muy subjetivo, debido a que generalmente utilizamos el sentido del tacto para entregar nuestra clasificación, y esta podría variar de una persona a otra. Un ejemplo de lo anterior, es cuando una persona toma un plato de comida caliente con la mano y otra, necesita de un paño para realizar la misma tarea.
Una de las reglas para la transferencia de calor es que siempre este se transferirá del cuerpo de mayor temperatura al de menor temperatura; este principio conocido con el nombre de equilibrio térmico, busca igualar las temperaturas de los cuerpos y es utilizado por muchos sistemas de refrigeración con el fin de regular la temperatura, como por ejemplo, el refrigerador o un aire acondicionado.
Por tanto, los términos de temperatura y calor, aunque relacionados entre sí, se refieren a conceptos diferentes: la temperatura es una propiedad de un cuerpo que se relaciona con la transferencia de calor de un cuerpo a otro; y el calor es un flujo de energía entre dos cuerpos a diferentes temperaturas. Por lo tanto, podemos afirmar que el calor es una forma de energía.
La transferencia de calor, necesariamente lleva consigo un aumento o disminución de temperatura, el que también provocará algunos cambios en las sustancias, como podría ser, cambios de Presión, resistencia eléctrica y la dilatación de los cuerpos. Los cambios de temperatura tienen que medirse a partir de otros cambios en las propiedades de una sustancia. Por ejemplo, el termómetro de mercurio convencional mide la dilatación de una columna de mercurio en un capilar de vidrio.
Como se menciono en el párrafo anterior, el termómetro nos entrega una graduación de la temperatura, es decir, nos entrega una medida no subjetiva como lo es, el frió o caliente. Para realizar esta graduación se puede utilizar una de las tres escalas para medir temperatura, la Celsius o centígrada [C], la Fahrenheit [F] o la Kelvin, también conocida como escala termodinámica [K].
La escala oficial de temperatura para el sistema MKS es el grado Kelvin (desde 1933) en honor al científico Británico Lord Kelvin (1824-1907). Pero en la actualidad son ampliamente utilizadas las escalas Celsius y Fahrenheit, por lo que se hace necesario contar con una forma de conversión, de una unidad a otra, las que se indican a continuación.
Conversión de escalas:
ºF = ºC *(9/5) + 32
ºC = ºK - 273
ºC = ºK - 273
En las escalas de temperaturas, se conoce como el cero absoluto al 0ºK que equivale a -273,15ºC que seria la temperatura mínima que podríamos encontrar. (se ha probado recientemente que existen temperaturas menores a los 0ºK).
Para Transformar de grados Kelvin a grados fahrenheit, basta con hacer un sistema de ecuaciones con las formulas entregadas anteriormente, tal como se muestra a continuación.
1º Despejo ºC de ºF = ºC *(9/5) + 32 quedando: ºC = (ºF - 32) x 5/9.
2º Igualo la ecuación anterior con ºC = ºK - 273 quedando:

Como se mide y transporta el calor
La cantidad de calor (Q) se expresa en las mismas unidades que la energía y el trabajo, es decir, en Joule. Otra unidad es la caloría y la kilocaloría, que equivale a 1.000 calorías que se emplea en nutrición. La energía mecánica se puede convertir en calor a través del rozamiento, y el trabajo mecánico necesario para producir 1 caloría se conoce como equivalente mecánico del calor. A una caloría le corresponden 4,1855 [Joule].
Otra unidad de medida ampliamente usada en la industria, es el BTU (British Termal Units), equivalente a 251.996 [cal]
Para Transportar el calor, es decir transferencia de energía, existen tres formas básicas, las que son mostradas en la siguiente figura.
Otra unidad de medida ampliamente usada en la industria, es el BTU (British Termal Units), equivalente a 251.996 [cal]
Para Transportar el calor, es decir transferencia de energía, existen tres formas básicas, las que son mostradas en la siguiente figura.
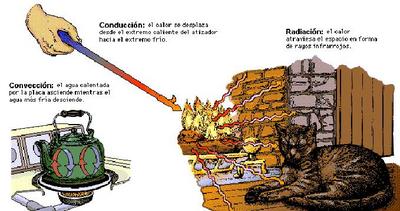
- La conducción utiliza un medio sólido para transferir calor.
- La convección utiliza un medio Líquido o gaseoso para el intercambio de moléculas frías por otras calientes, generando un movimiento de partículas en estos medios.
- La radiación utiliza las ondas electromagnéticas (infrarrojo), para transmitir calor y no necesitan un medio físico para propagarse. Estas ondas, están compuestas por fotones (Paquetes de energía) que hacen que existan cambios de temperaturas, debido a la capacidad de Absorber y emitir energía de los cuerpos.
Efectos de la temperatura en los materiales
Uno de los efectos que provoca la variación de temperatura en los materiales, es la dilatación, esta dependerá exclusivamente del material que se desea analizar, esta dilatación se dice que es proporcional a la variación de temperatura y su formula es:
ΔL= α L0 ΔT
Donde:
L0 = longitud inicial
ΔT = variación de la temperatura (ºC)
α = Coeficiente de dilatación [1/ ºC]
Algunos valores característicos del coeficiente de dilatación en distintos materiales, son los siguientes:
L0 = longitud inicial
ΔT = variación de la temperatura (ºC)
α = Coeficiente de dilatación [1/ ºC]
Algunos valores característicos del coeficiente de dilatación en distintos materiales, son los siguientes:
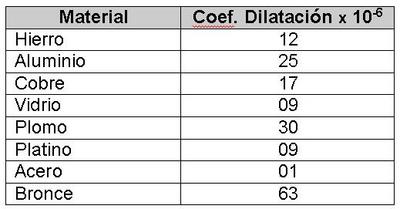
Este cálculo es de mucha importancia en la construcción de puentes y edificios debido a que los materiales podrán contraerse con el frío y expandirse con el calor, en otras palabras su longitud cambiara y para ello se debe disponer de las holguras necesarias. Por ejemplo una viga de bronce de 10 metros al tener una variación de temperatura de 50ºC, podría expandirse hasta 7,1 [cm].
Calor especifico
“El calor especifico (c) de un material se refiere a la cantidad de calor que debe fluir de o hacia una unidad de masa, para cambiar en un grado su temperatura.”
Por ejemplo, el aluminio tiene un peso especifico de 0.21 [cal /g ºC]. Que significa que para que la masa de 1 gramo de aluminio aumente su temperatura en 1ºC, se necesita un flujo de calor de 0.21 [cal].
La formula para calcular el calor, utilizando el calor específico de una sustancia es:
“El calor especifico (c) de un material se refiere a la cantidad de calor que debe fluir de o hacia una unidad de masa, para cambiar en un grado su temperatura.”
Por ejemplo, el aluminio tiene un peso especifico de 0.21 [cal /g ºC]. Que significa que para que la masa de 1 gramo de aluminio aumente su temperatura en 1ºC, se necesita un flujo de calor de 0.21 [cal].
La formula para calcular el calor, utilizando el calor específico de una sustancia es:
Q = c m ΔT
Donde:
Q = calor
c = calor especifico
m = masa
ΔT = variación de temperatura
Q = calor
c = calor especifico
m = masa
ΔT = variación de temperatura
Cambios de estados de la materia debido a la Temperatura
Como se sabe la materia, la podemos encontrar en distintos estados (Sólido, Liquido y Gaseoso) y el estado en el cual encontramos la materia dependerá de la temperatura. Dependiendo del cambio de estado, este puede ser identificado con los siguientes nombres:

Cuando se produce un cambio de estado se conoce como calor latente, es decir, la temperatura en la materia permanece constante, en cambio cuando hay una variación de temperatura, esto se conoce como calor sensible. Estas dos formas de calor son las que utilizará un cuerpo para pasar de un estado a otro.


